Neue Erkenntnisse zur Entstehung der Arterienverkalkung
Seit einiger Zeit wird vermutet, dass Zellen des Immunsystems an der Entstehung der Arteriosklerose beteiligt sind, einer krankhaften Veränderung der arteriellen Blutgefässe, umgangssprachlich auch Arterienverkalkung genannt. Berner Forschende am Institut für Pathologie haben nun einen Rezeptor auf Immunzellen ins Visier genommen, welcher normalerweise die Abwehr gegen mikrobielle Erreger verstärkt. Tatsächlich wird dieser Rezeptor aber auch durch eine längerfristige fettreiche Ernährung aktiviert und trägt dadurch zur Arteriosklerose bei.
Weltweit fordern kardiovaskuläre Krankheiten, wie die Arterienverkalkung als hauptsächlicher Verursacher von Herzinfarkt und Schlaganfall, mehr Todesopfer als Krebs oder Infektionskrankheiten. Lange galt die Auffassung, dass Arteriosklerose primär durch die Ablagerung von Fetten in den Gefässwänden zustande kommt. Tatsächlich scheinen aber vor allem Entzündungsprozesse diese Krankheiten zu verursachen. Normalerweise sind Immunzellen an der Eliminierung von Krankheitserregern beteiligt, die in den Körper eingedrungen sind. Schon in einer frühen Phase einer Infektion können Zellen des angeborenen Immunsystems mit Hilfe diverser Rezeptoren bestimmte Strukturen auf Mikroben erkennen, die Erreger aufnehmen und abbauen und dabei mit Hilfe von ausgeschütteten Botenstoffen wirkungsvoll Alarm schlagen.
«Manche Rezeptoren des Immunsystems können indes nicht nur fremde Strukturen, sondern auch vom Körper gebildete Moleküle wie Cholesterin-Kristalle und bestimmte Fettsäuren als Gefahrensignale erkennen und lösen dann eine Immunreaktion aus, die in seltenen Fällen auch Gewebe und Organe schädigt», erklärt Christoph Müller vom Institut für Pathologie der Universität Bern. Seine Forschungsgruppe hat aufgrund früherer Arbeiten besonders einen Immunrezeptor untersucht, den sogenannten TREM-1 Rezeptor. Dieser reagiert normalerweise auf bakterielle Infektionen und verstärkt die mikrobielle Abwehr. Die Forschenden konnten zeigen, dass TREM-1 bei einer fettreichen Ernährung ebenfalls aktiviert wird und zur Arteriosklerose beiträgt. Müller: «Die Resultate zeigen nicht nur, wie zweischneidig Immunrezeptoren sein können, sondern eröffnen auch neue Perspektiven für mögliche immunbasierte Therapien in der Arteriosklerose». Die Studie wurde nun im Journal «Nature Communications» publiziert.
Das Janusgesicht von Immunrezeptoren
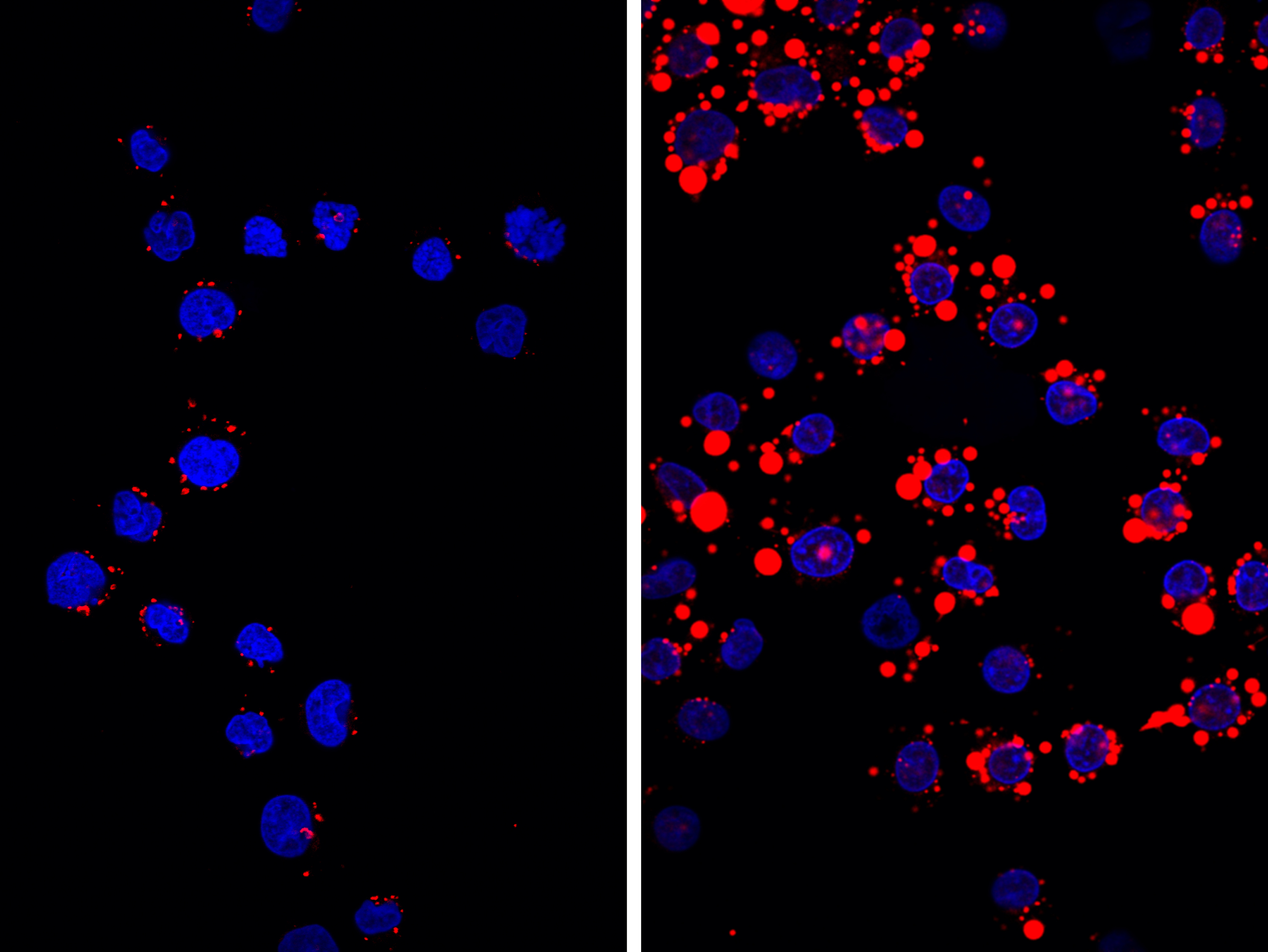
Schon lange haben Pathologinnen und Pathologen sogenannte Schaumzellen als wesentlichen Bestandteil von arteriosklerotischen Gefässveränderungen wahrgenommen. Diese stammen von Monozyten ab (im Blut zirkulierenden Zellen des Immunsystems). Diese Zellen können in die Blutgefässwände einwandern, wo sie bei einer fettreichen Ernährung vermehrt über ihre Rezeptoren die Fette aufnehmen, sich in Schaumzellen umwandeln und dadurch direkt zum Wachstum der arteriosklerotischen Veränderungen der Gefässwände beitragen. Da sie Botenstoffe produzieren, locken sie zudem weitere Immunzellen an – die Entzündung wird chronisch, bis es schliesslich zum gefürchteten Aufplatzen der Gefässwände und der möglichen Bildung eines lebensbedrohlichen Thrombus kommt. «Während es die Immun- und Schaumzellen in der Arterienwand eigentlich ‹nur gut meinen› und die Fettablagerungen entfernen wollen, können ihre Aktivitäten auch weitreichende, negative Folgen haben», sagt Leslie Saurer vom Institut für Pathologie, Ko-Autorin der Studie.
Immunrezeptor TREM-1 als «bad guy»
Als «bad guy» bei der Entstehung der Schaumzellen und damit von Arteriosklerose hat die Arbeitsgruppe von Christoph Müller den Immunrezeptor TREM-1 ausgemacht. Dieser kommt ausschliesslich auf den Immunzellen, insbesondere auf Granulozyten, Monozyten und Makrophagen vor. In Zusammenarbeit mit weiteren Forschenden aus Bern, Lausanne und Heidelberg hat Studien-Erstautor Daniel Zysset im Rahmen seiner Dissertationsarbeit am Institut für Pathologie untersucht, wie TREM-1 zur Entstehung von Arteriosklerose beiträgt: «Tatsächlich konnten wir eine erhöhte TREM-1 Produktion in arteriosklerotischen Gefässwänden nachweisen», erläutert Zysset. Dabei begünstigt TREM-1 die Arteriosklerose gleich in mehrfacher Weise: So steuert TREM-1 unter dem Einfluss einer lipidreichen Ernährung eine vermehrte Produktion von Monozyten im Knochenmark, was eine erhöhte Infiltration der Gefässwände mit Makrophagen zur Folge hat. Damit ist es aber nicht genug: Überraschenderweise fördert TREM-1 über eine vermehrte Bildung des Lipid-Aufnahme Rezeptors CD36 auf Monozyten und Makrophagen direkt deren gezielte Umwandlung in Schaumzellen. Nicht zuletzt verstärkt TREM-1 zusammen mit Lipidmolekülen auch die Produktion von entzündungsfördernden Botenstoffen. Die wesentliche Bedeutung des TREM-1 Rezeptors bei diesen Vorgängen wird durch die Beobachtungen gestützt, dass TREM-1 defiziente Mäuse nach einer fettreichen Ernährung signifikant weniger Arteriosklerose entwickeln. Gerade die Funktion von TREM-1 als Verstärker von Immunantworten macht den Rezeptor als mögliches therapeutisches Ziel für diverse chronische Entzündungskrankheiten interessant: Wie die Forschungsgruppe von Christoph Müller in einer früheren Studie zeigen konnte, hatte nämlich eine komplette Abwesenheit von TREM-1 in den Mäusen bisher keinen sichtbar negativen Einfluss auf die erfolgreiche Immunabwehr gegen diverse mikrobielle Erreger.
Angaben zur Publikation:Daniel Zysset, Benjamin Weber, Silvia Rihs, Jennifer Brasseit, Stefan Freigang, Carsten Riether, Yara Banz, Adelheid Cerwenka, Cédric Simillion, Pedro Marques-Vidal, Adrian Ochsenbein, Leslie Saurer & Christoph Mueller: TREM-1 links dyslipidemia with inflammation and lipid deposition in atherosclerosis, Nature Communications 2016, doi: 10.1038/ncomms13151 |
20.10.2016