Detaillierter «Katalog» von Abbau-Produkten in Zellen erstellt
Zellen haben eine eigene Qualitätskontrolle, um die Produktion und Anhäufung schädlicher Proteine zu verhindern. Diese Qualitätskontrolle ist essenziell für die korrekte Embryonalentwicklung in allen Säugetieren und spielt eine wichtige Rolle bei Tumoren und genetisch bedingten Krankheiten wie Cystischer Fibrose. Eine Gruppe von Forschenden der Universität Bern und der Universität Basel hat nun «Baupläne», die zu fehlerhaften Proteinen führen und normalerweise in den Zellen erkannt und rasch abgebaut werden, erstmals sichtbar gemacht und katalogisiert. Dies führt zu einem besseren Verständnis dieses Abbau-Mechanismus und hilft bei der Entwicklung neuer therapeutischer Ansätze.
Wenn Produkte eine Fabrik verlassen, müssen sie zuvor noch Qualitätskontrollen durchlaufen. In ähnlicher Weise gibt es bei der Expression unserer Gene mehrere solcher Qualitätskontrollen, die sicherstellen, dass die Endprodukte, die hergestellten Proteine, keine Fehler enthalten und funktionsfähig sind.
In einer neuen Studie haben Professor Oliver Mühlemann und sein Team an der Universität Bern in Zusammenarbeit mit Forschenden aus dem Biozentrum in Basel neue Erkenntnisse über einen Qualitätskontrollmechanismus gewonnen, der fehlerhafte Genprodukte aus den Zellen entfernt und so die fehlerfreie Expression unserer Gene gewährleistet. Diese Studie wurde nun in der Fachzeitschrift Genome Biology veröffentlicht.
Qualitätskontrolle gegen schadhafte Proteine
Jede Zelle enthält Tausende unterschiedliche Proteine (Eiweisse), von denen jedes eine bestimmte Aufgabe erfüllt. Um ein spezifisches Protein zu produzieren, muss ein Gen zunächst in ein Molekül der mRNA (Messenger-RNA oder Boten-RNA) kopiert werden. Dieses wird weiterverarbeitet und dient schliesslich als Bauplan für die Proteinproduktion in der zellulären Proteinfabrik.
«Es ist wichtig, dass diese mRNA korrekt hergestellt und verarbeitet wird – denn wenn der Bauplan Fehler enthält, entsteht ein fehlerhaftes Protein, das ein potenzielles Risiko für die Zelle darstellt», sagt Oliver Mühlemann vom Departement für Chemie, Biochemie und Pharmazie (DCBP) und NCCR RNA & Disease. Daher verfügt die Zelle über eine Reihe von Qualitätskontrollmechanismen, um fehlerhafte mRNAs aufzuspüren und zu entfernen. Einer dieser Mechanismen, der im Fachjargon als Nonsense-mediated mRNA decay (NMD) bezeichnet wird, zielt speziell auf mRNAs ab, welche die Produktion eines Proteins zu früh abbrechen. Diese mRNAs enthalten einen Code, welcher der Proteinfabrik zu früh signalisiert, die Produktion eines Proteins zu stoppen – noch bevor das Protein vollständig hergestellt wurde.
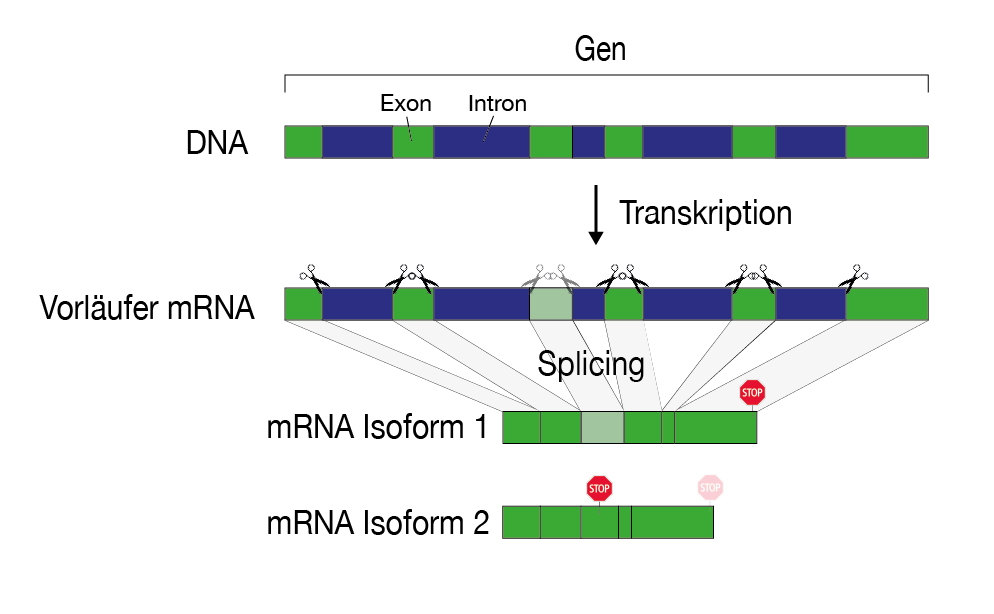
Solche fehlerhaften mRNAs entstehen meistens bei den Verarbeitungsschritten, welche eine mRNA durchlaufen muss, bevor sie als fertige Vorlage für die Proteinproduktion dient. Ein solcher Verarbeitungsschritt ist das Splicing, bei dem gewisse Sequenzen (die Introns) aus der ursprünglichen mRNA herausgeschnitten und die restliche mRNA (die Exons) wieder zusammengeschweisst werden. Denn in menschlichen Zellen liegt ein Gen auf der DNA nicht als durchgehender Abschnitt vor, sondern es ist durch DNA-Abschnitte unterbrochen, die für die Produktion eines Proteins nicht benötigt werden.
Der modulare Aufbau eines Gens ermöglicht, dass aus ein und demselben Gen verschiedene mRNA-Varianten und somit auch Proteinvarianten entstehen können. Dies ergibt eine Vielzahl möglicher Kombinationen und Proteine, was für die Evolution komplexer Organismen besonders wichtig ist. Dieser Prozess birgt jedoch auch das Risiko, fehlerhafte Proteine zu produzieren.
Abbauprodukte erstmals sichtbar gemacht
In gesunden Zellen, in denen die NMD-Qualitätskontrolle aktiv ist, kann man fehlerhafte mRNAs kaum nachweisen, da sie nach der Produktion rasch erkannt und abgebaut werden. Wie lässt sich dann feststellen, welche mRNAs der NMD-Qualitätskontrolle zum Opfer fallen? Indem man die Hauptakteure des Qualitätskontrollprozesses ausschaltet. Damit häufen sich die falsch gespleissten mRNAs in den Zellen an. Aber hier liegt die nächste Herausforderung: Diese mRNAs kommen vom gleichen Gen wie die «korrekten» mRNA-Varianten und sind diesen daher sehr ähnlich. Mit bisherigen Sequenzier-Methoden waren sie kaum zu unterscheiden.
Bisherige Methoden zum Aufspüren von mRNAs in Zellen beruhen auf der Sequenzierung vieler kleiner Abschnitte, die später mit bioinformatischen Tricks wieder zu einem Ganzen zusammengesetzt werden. Evan Karousis vom DCBP und NCCR RNA & Disease, Erstautor der Studie, erklärt, dass in der aktuellen Studie eine neue Methode angewandt wurde, die mRNAs von A bis Z an einem Stück entschlüsselt. «So kann jede detektierte mRNA eindeutig einer mRNA-Variante zugeordnet werden», so Karousis. Mit diesen technischen Kniffen gelang es den Forschenden erstmals, einen nahezu vollständigen Katalog von NMD-Abbauprodukten in menschlichen Zellen zu erstellen.
«Katalog» von mRNAs für die weitere Forschung und Entwicklung neuer Therapie-Ansätze
Durch diese Klassifizierung können Merkmale untersucht werden, welche NMD-Abbauprodukte von «herkömmlichen» mRNAs unterscheiden. «Häufen sich gewisse mRNAs an, die in gesunden Zellen durch die NMD-Qualitätskontrolle abgebaut werden, kann dies zur Entstehung von Tumoren beitragen, wie dies beispielsweise bei Magenkrebs der Fall ist», erklärt Oliver Mühlemann. Versteht man also, wie die Qualitätskontrolle die fehlerhaften von korrekten mRNAs unterscheiden kann, trägt dieses Wissen wesentlich dazu bei, neue therapeutische Ansätze für Krankheiten zu entwickeln, bei denen die Qualitätskontrolle beeinträchtigt ist.
Publikation:Karousis E, Gypas F, Zavolan M, Mühlemann O. (2021) Nanopore sequencing reveals endogenous NMD-targeted isoforms in human cells. Genome Biology, 22(1):223 |
NCCR RNA & Disease – Die Rolle von RNA in KrankheitsmechanismenDer Nationale Forschungsschwerpunkt (NCCR) «RNA & Disease – Die Rolle von RNA in Krankheitsmechanismen» widmet sich der Untersuchung einer sehr zentralen Klasse von Molekülen. Die RNA (Ribonukleinsäure) ist der Drehpunkt vieler Lebensvorgänge und funktional weit vielfältiger als ursprünglich angenommen. Sie definiert beispielsweise, wann und in welchen Zellen welche Gene aktiv oder inaktiv sind. Läuft bei dieser genetischen Regulation nicht alles rund, entstehen Krankheiten – etwa Herzerkrankungen, Krebs, Hirn- und Stoffwechselkrankheiten. Der NCCR vereint Schweizer Forschungsgruppen, die sich mit verschiedenen Aspekten der RNA-Biologie befassen. Indem der NCCR aufdeckt, welche regulatorischen Mechanismen während einer Erkrankung aus dem Ruder laufen, zeigt er auch neue therapeutische Angriffsziele auf. Die Universität Bern ist Leading house des NCCR, die ETH Zürich ist co-leading. Nationale Forschungsschwerpunkte sind ein Forschungsinstrument des Schweizerischen Nationalfonds SNF. Während die meisten Leute den Begriff «DNA» kennen, ist der Begriff «RNA» viel weniger geläufig. Was also sind RNA-Moleküle genau? Die Website «Molecool.ch», die vom NCCR RNA & Disease der Universität Bern und der ETH Zürich entwickelt wurde, bietet einen Überblick über die vielfältigen Funktionen des RNA-Moleküls und deren Bedeutung für die Spitzenforschung und Medikamentenentwicklung. |
19.08.2021