Création d’un « catalogue » détaillé de produits de dégradation contenus dans les cellules
Les cellules ont leur propre contrôle de qualité pour empêcher la production et l'accumulation de protéines nocives. Ce contrôle de qualité est essentiel au bon développement embryonnaire de tous les mammifères et joue un rôle important dans les tumeurs et les maladies génétiques telles que la mucoviscidose. Un groupe de recherche de l'Université de Berne et de l'Université de Bâle a, pour la première fois, visualisé et catalogué les « plans » qui conduisent à des protéines défectueuses et qui sont normalement reconnus et rapidement dégradés dans les cellules. Cela conduit à une meilleure compréhension de ce mécanisme de dégradation et aide au développement de nouvelles approches thérapeutiques.
Lorsque les produits quittent une usine, ils doivent encore passer par des contrôles de qualité préalables. De même, lorsque nous exprimons nos gènes, il existe plusieurs contrôles de qualité de ce type pour garantir que les produits finaux, les protéines fabriquées, ne contiennent aucune erreur et sont fonctionnels. Dans une nouvelle étude, le professeur Oliver Mühlemann et son équipe de l'université de Berne, en collaboration avec des chercheur·euse·s du Biozentrum de Bâle, ont acquis de nouvelles connaissances sur un mécanisme de contrôle de la qualité qui élimine les produits génétiques défectueux des cellules, garantissant ainsi l'expression sans erreur de nos gènes. Cette étude vient d'être publiée dans la revue Genome Biology.
Contrôle de qualité contre les protéines défectueuses
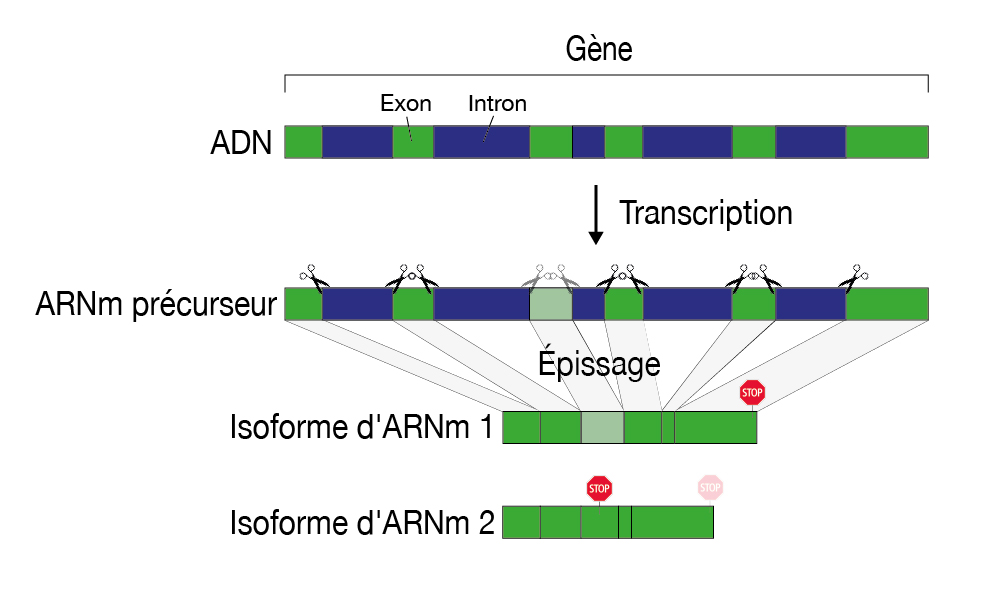
Chaque cellule contient des milliers de protéines différentes, chacune d'entre elles accomplissant une tâche spécifique. Pour produire une protéine spécifique, un gène doit d'abord être copié dans une molécule d'ARNm (ARN messager). Cette dernière est ensuite traitée et sert finalement de modèle pour la production de protéines dans l'usine à protéines cellulaire. « Il est important que cet ARNm soit produit et traité correctement, car si le schéma directeur contient des erreurs, une protéine défectueuse est produite, ce qui représente un risque potentiel pour la cellule », explique Oliver Mühlemann du Département de chimie, biochimie et pharmacie (DCBP) et du PRN RNA & Disease. Par conséquent, la cellule dispose d'un certain nombre de mécanismes de contrôle de la qualité pour détecter et éliminer les ARNm défectueux. L'un de ces mécanismes, connu dans le jargon technique sous le nom de Nonsense-mediated mRNA decay (NMD), cible spécifiquement les ARNm qui cessent de produire une protéine trop tôt. Ces ARNm contiennent un code qui signale à l'usine à protéines d'arrêter la production d'une protéine trop tôt - avant même que la protéine ait été complètement produite.
Ces ARNm défectueux apparaissent généralement au cours des étapes de traitement qu'un ARNm doit subir avant de servir de modèle fini pour la production de protéines. L'une de ces étapes de traitement est l'épissage, au cours duquel certaines séquences (les introns) sont coupées de l'ARNm d'origine et les ARNm restants (les exons) sont épissés ensemble. En effet, dans les cellules humaines, un gène n'est pas présent sur l'ADN en tant que section continue, mais est interrompu par des sections d'ADN qui ne sont pas nécessaires à la production d'une protéine.
La structure modulaire d'un gène permet à différentes variantes d'ARNm et donc aussi à des variantes de protéines de naître d'un seul et même gène. Il en résulte une multitude de combinaisons et de protéines possibles, ce qui est particulièrement important pour l'évolution des organismes complexes. Toutefois, ce processus comporte également le risque de produire des protéines défectueuses.
Des produits de dégradation rendus visibles pour la première fois
Dans les cellules saines dans lesquelles le contrôle de qualité NMD est actif, les ARNm défectueux peuvent difficilement être détectés car ils sont rapidement reconnus et dégradés après leur production. Comment déterminer alors quels ARNm sont victimes du contrôle de qualité de la NMD ? En éliminant les acteurs clés du processus de contrôle de la qualité. Ainsi, les ARNm incorrectement épissés s'accumulent dans les cellules. Mais c'est là que réside le prochain défi : ces ARNm proviennent du même gène que les variantes d'ARNm « correctes » et leur sont donc très similaires. Avec les méthodes de séquençage précédentes, on pouvait à peine les distinguer.
Les méthodes précédentes de détection des ARNm dans les cellules reposent sur le séquençage de nombreuses petites sections qui sont ensuite réassemblées en un tout grâce à des astuces bioinformatiques. Evan Karousis du DCBP et du PRN RNA &Disease, premier auteur de l'étude, explique que l'étude actuelle a utilisé une nouvelle méthode qui décode les ARNm de A à Z en un seul morceau. « De cette manière, chaque ARNm détecté peut être attribué sans ambiguïté à une variante d'ARNm », explique M. Karousis. Grâce à ces astuces techniques, les chercheur·euse·s ont réussi pour la première fois à créer un catalogue presque complet des produits de dégradation de la NMD dans les cellules humaines.
« Catalogue » d'ARNm pour la poursuite des recherches et le développement de nouvelles approches thérapeutiques
Cette classification permet d'étudier les caractéristiques qui distinguent les produits de dégradation NMD des ARNm « classiques ». « Si certains ARNm s'accumulent et sont dégradés dans les cellules saines par le contrôle de qualité NMD, cela peut contribuer au développement de tumeurs, comme c'est le cas pour le cancer gastrique, par exemple », explique Oliver Mühlemann. Ainsi, si l'on comprend comment le contrôle de la qualité peut distinguer les ARNm défectueux des ARNm corrects, cette connaissance contribue de manière significative au développement de nouvelles approches thérapeutiques pour les maladies dans lesquelles le contrôle de la qualité est altéré.
Publication:Karousis E, Gypas F, Zavolan M, Mühlemann O. (2021) Nanopore sequencing reveals endogenous NMD-targeted isoforms in human cells. Genome Biology, 22(1):223 |
PRN RNA & Disease - Le rôle de l'ARN dans les mécanismes pathologiquesLe Pôle de recherche national (PRN) « RNA & Disease - The Role of RNA in Mécanismes » est consacré à l'étude d'une classe très centrale de molécules. L'ARN (acide ribonucléique) est au cœur de nombreux processus vitaux et ses fonctions sont beaucoup plus variées qu'on ne le pensait à l'origine. Par exemple, elle définit quand et dans quels gènes sont actifs ou inactifs. Si tout ne se passe pas comme prévu dans cette régulation génétique, des maladies apparaissent - telles que les maladies cardiaques, le cancer, les maladies cérébrales et métaboliques. Le PRN réunit des groupes de recherche suisses travaillant sur divers aspects de la biologie de l'ARN. En découvrant les mécanismes de régulation qui se dérèglent au cours d'une maladie, le PRN identifie également de nouvelles cibles pour une intervention thérapeutique. L'Université de Berne est le chef de file du PRN, l'ETH Zurich en est le codirecteur. Les Pôles de recherche nationaux sont un instrument de recherche du Fonds national suisse de la recherche scientifique FNS. Si la plupart des gens connaissent le terme "ADN", le terme "ARN" est beaucoup moins connu. Alors, qu'est-ce que la molécule ARN ? Le site web "Molecool.ch", développé par le PRN de l'Université de Berne et de l'ETH Zurich, donne une vue d'ensemble des fonctions de la molécule d'ARN et leur importance pour la recherche de pointe et le développement de médicaments. |
19.08.2021